As propriedades da água: isótopos e estrutura molecular.
As propriedades da água 1: geral
As propriedades da água 2: propriedades físicas e químicas
Composição isotópica da água
A água é uma mistura de várias combinações de isótopos de oxigênio e hidrogênio, que diferem uns dos outros no número de nêutrons associados aos prótons no núcleo.
1H,2 H (deutério)3H (trítio)
16O, 17O,18O.
As relações isotópicas são:
Para hidrogênio:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
O trítio é um elemento instável, o seu tempo (meia-vida) está anos 12,5.
Para oxigênio:
18O/16O = 1 / 500
17O/16O = 1 / 2500
4 as principais espécies moleculares ea sua frequência é o seguinte:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = muito baixo
Diferentes isótopos induzir diferenças nas propriedades físicas das moléculas, em particular, a sua densidade, mas as propriedades químicas continuam a ser a mesma.
Água pesada D2O existe em seu estado natural, mas em muito
baixo. Para ter uma quantidade apreciável, é necessário dominar as técnicas de separação isotópica: este foi um dos desafios fundamentais durante a última guerra mundial para o preparo da arma atômica.
A composição isotópica dos componentes químicos da água é usada na estimativa de parâmetros termodinâmicos, como temperatura;
o relatório 18 O/16O o gelo das calotas polares e a água das águas subterrâneas fósseis fornecem informações sobre o clima do passado.
A evaporação da água do oceano ocorre com o fracionamento isotópico: o isótopo leve de oxigênio é preferencialmente evaporado para o isótopo pesado. Os oceanos são mais ricos em isótopos pesados do que a água das nuvens e da precipitação.
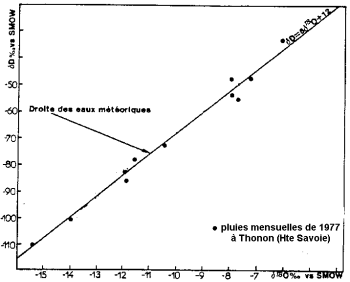
Conteúdo isotópico estável de precipitação (após Blavoux e Letolle, 1995).
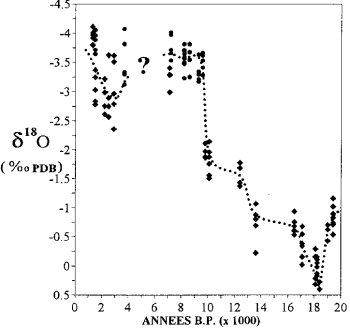
Variação no conteúdo de isótopos de oxigênio em corais em Mayotte (após Casanova et al., 1994).
Estrutura da molécula
Os átomos de hidrogênio e oxigênio agrupam seus elétrons para formar uma camada completa como a do néon. Na verdade, o átomo de oxigênio carece de 2 elétrons para completar sua camada eletrônica, são os 2 átomos de hidrogênio que o fornecem. A molécula de H2O formada é estável.
Oxigênio: prótons 8 8 + nêutrons
Hidrogénio: 2 (2 * (1 1 nêutrons prótons +))
Total de: prótons 10 10 equilibrar cargas de elétrons.
Os núcleos de hidrogênio têm um lado do oxigênio para formar uma característica “cabeça de Mickey” (o hidrogênio sendo as orelhas).
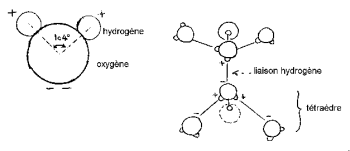
O ângulo HOH é 104,474 ° (característica da geometria tetraédrica). A distância entre o oxigênio e o átomo de hidrogênio é próxima a 1 A ° (0,95718 A °) no vapor. O diâmetro efetivo da molécula é da ordem de 2,82 A °.
Cargas elétricas são distribuídas de forma desigual nesta pequena molécula. Os elétrons são mais fortemente atraídos pelo átomo de oxigênio do que pelo átomo de hidrogênio. Existem 2 centros de cargas positivas perto dos núcleos de hidrogênio e 2 centros de cargas negativas perto do núcleo de oxigênio. Esse desequilíbrio na distribuição de cargas, combinado com a geometria não linear da molécula de água, se manifesta na existência de um forte momento de dipolo elétrico. A molécula de água é polar; ele se comporta como um dipolo elétrico que pode assim ligar-se a outras moléculas polares. Na verdade, as moléculas de água podem ser inseridas entre os íons constituintes de um cristal, direcionando sua parte de carga elétrica oposta em direção a eles. A atração dos íons cristalinos é bastante enfraquecida e a coesão do cristal é reduzida, o que facilita sua dissolução. As propriedades polares da molécula de água explicam a técnica de aquecimento por microondas. Na verdade, uma molécula polarizada se orienta em relação a um campo elétrico; se isso variar, a molécula segue a mudança na orientação. A partir de uma certa frequência, alguns GHz para a água, os movimentos das moléculas produzem calor por fricção. Os fornos domésticos normalmente operam a uma frequência de 2,45 GHz, que é UHF.
Os 3 núcleos da molécula não são estacionários, eles se movem em relação uns aos outros, a molécula vibra e se torce. Na água líquida, as moléculas tendem a se associar: as cabeças de Mickey ligam a orelha ao queixo por ligações de hidrogênio. Na verdade, dos 8 elétrons periféricos de oxigênio, apenas 4 estão envolvidos em ligações covalentes com átomos de hidrogênio. Os 4 elétrons restantes são agrupados em 2 pares chamados dupletos de elétrons livres. Cada um desses dupletos com carga elétrica negativa pode formar uma ligação eletrostática com um átomo de hidrogênio carregado positivamente de uma molécula de água próxima. A ligação de hidrogênio, que é estável à temperatura ambiente, é, no entanto, frágil em comparação com a ligação covalente. Na molécula de água, a geometria formada pela direção das 2 ligações covalentes e dos 2 dupletos eletrônicos livres é próxima à de um tetraedro cujo centro é ocupado pelos núcleos de oxigênio.
No entanto, a estrutura em grande escala da molécula de água ainda é mal conhecida. Os espectros de difração de raios-X e nêutrons fornecem 2 valores principais: um sinal correspondente a 1 A °, distância entre os núcleos de hidrogênio e oxigênio e um valor de 2,84 a 4 A ° variando de acordo com a temperatura e correspondendo à distância entre 2 núcleos de oxigênio. A difratometria de raios X também permite saber o número médio de moléculas por unidade de volume de líquido localizadas a uma distância R de uma determinada molécula. Uma molécula de água tem uma média de 4,4 vizinhos, o que sugere uma malha tetraédrica. Além das moléculas ligadas por ligações de hidrogênio, existem outras moléculas não ligadas, o que pode explicar por que o número de moléculas vizinhas é ligeiramente maior do que 4, e não 4 exatamente como um estado tetraédrico cristalizado estrito imporia. A rede cristalina de moléculas ligadas por ligações de hidrogênio formaria cavidades onde as moléculas não ligadas seriam alojadas. Outra hipótese é baseada na distorção das ligações de hidrogênio. Este último, originalmente linear, ou seja, com os átomos O - HO alinhados, poderia se torcer em vários graus e permitir que moléculas mais distantes do que as vizinhas próximas se aproximassem da molécula central.
Modelos teóricos foram desenvolvidos recentemente usando computadores poderosos. Eles indicam que cerca de 80% das moléculas de água estão envolvidas em 3 ou 4 ligações de hidrogênio; por outro lado, eles excluem a presença de moléculas não ligadas. A modelagem por computador sugere que, à medida que a água esfria, as redes de moléculas cada vez mais se parecem com hexágonos semelhantes às do gelo.
O estado sólido corresponde a um arranjo cristalino mais rígido. À pressão normal, o gelo tem uma estrutura hexagonal. Em baixa temperatura (abaixo de -80 ° C), pode assumir uma estrutura cúbica. Cargas elétricas podem se mover na rede cristalina e produzir defeitos de cristal do tipo iônico: próton hidratado H3O + e íon hidroxila OH-. A estrutura cristalina do gelo não corresponde ao empilhamento mais compacto possível de moléculas. Na fusão, os defeitos colapsam porque as ligações de hidrogênio se rompem e as moléculas se aproximam: a densidade aumenta a um máximo a 4 ° C. Posteriormente, na água líquida, o aumento da temperatura separa as moléculas e a densidade diminui.
Detalhes, referências e bibliografia:
Blavoux B. e Letolle R. (1995) - Contribuição das técnicas isotópicas ao conhecimento das águas subterrâneas. Geochronics, 54, p. 12-15.
Caro P. (1990) - As propriedades físicas e químicas da água. O grande livro da água, La Villette, p. 183-194.
Eagland D. (1990) - A estrutura da água. La Recherche, 221, p. 548-552.
Maidment DR (1992) - Manual de hidrogeologia. Mc Graw Hill.
Casanova J., Colonna M. e Djerroud K. (1994) - Geoprospectiva - paleoclimatologia. Rapp. cient. BRGM, pág. 76-79.

